2024年は機能性表示食品を販売している企業や、関係する企業にとっては
かなりの激震が走った年になりました。
1月には多くの企業が安全性評価に使用していた「ナチュラルメディシンデータベース」の
利用規約が変更になり、届出済の製品の変更届けが相次ぎました。
3月に「紅麹」配合製品の健康被害が起こり、
それを受けて5月に機能性表示食品を巡る検討会が開催され、
機能性表示食品制度の信憑性を高める観点から、
8月に食品衛生法、食品表示法の一部を改正する内閣府令が公布されました。
そもそも、機能性表示食品とは?
機能性表示食品制度とは、国の定めるルールに基づき、事業者が食品の安全性と機能性に関する
科学的根拠などの必要な事項を、販売前に消費者庁長官に届け出れば、
機能性を表示することができる制度です。
特定保健用食品(トクホ)と異なり、国が審査を行いませんので、事業者は自らの責任において、
科学的根拠を基に適正な表示を行う必要があります。
機能性表示食品については、事業者が消費者庁長官に届け出た内容
(安全性及び機能性の根拠に関する情報、生産・製造及び品質の管理に関する情報等)は、
消費者庁ウェブサイトで誰でも確認できることとしています。
(消費者庁ホームページより抜粋)
では、機能性表示食品制度はどのように変わったのでしょうか。
24年9月1日から施行された主な改正内容をまとめてみました。
健康被害情報の取り扱い
2024年9月1日施行、即日実施で健康被害の情報提供が義務化されました。

提供期限については、重篤度等に対応した明確なルールを設ける
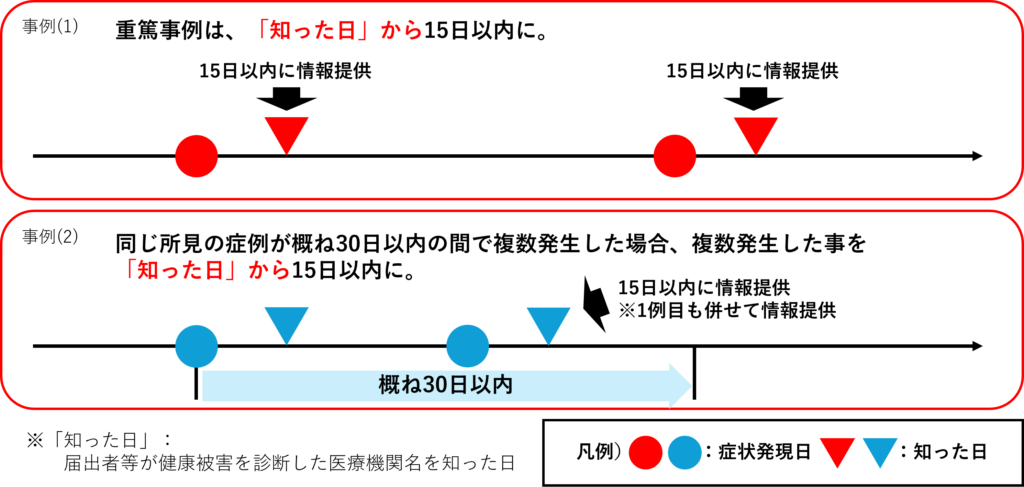
2つ事例をあげさせていただいておりますが、
上記以外にも様々なパターンがございますのでご注意ください。
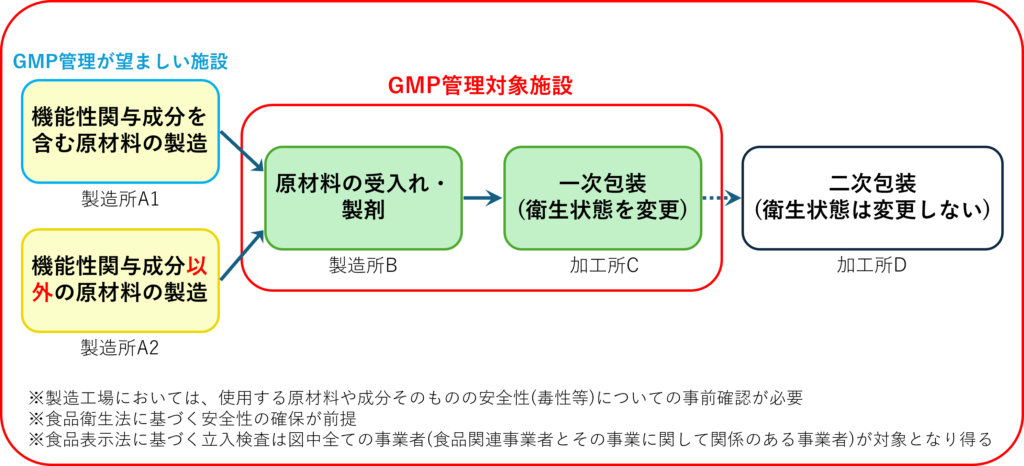
GMPの要件化
2024年9月1日施行で、2026年9月1日実施と2年間の猶予期間が設けられていますが、
製造工程管理による製品の品質の確保を徹底する観点から、機能性表示を行うサプリメント*については
GMPに基づく製造管理を届出者の遵守事項とすることになります。
*機能性表示食品のうち天然抽出物等を原材料とする錠剤、カプセル剤等食品
届出情報の表示方法の見直し
容器包装の表示情報についても見直しがなされ、表示事項が2024年9月1日施行で改正されました。
ただし、事業者の実行可能性(包材の切り替え等)を考慮し2年間の猶予期間が設けられ、
2026年9月1日から実施されます。
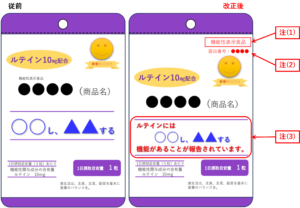
- 機能性表示食品である旨は、容器包装の主要面の上部に「機能性表示食品」の文字を枠で囲んで表示する。
- 届出番号は、機能性表示食品である旨の表示に近接した箇所に表示する。
- SR:機能性関与成分が有する機能性を表示する場合にあたっては、機能性関与成分の名称及び当該機能性関与成分が有する機能性を科学的根拠に基づき表示する。
その際、当該機能性について報告されている旨を的確に示す文言を表示する。
⇒SRでの届出で「〇〇(機能)する」「〇〇を下げる」等の言い切る表現は不可に。
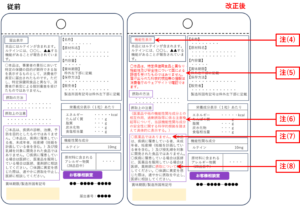
RCT:機能性関与成分を含有する食品が有する機能性を表示する場合にあたっては、
機能性関与成分の名称及び当該機能性関与成分を含有する食品が有する機能性を科学的根拠に基づき表示する。
⇒RCTでの届出では「〇〇(機能性関与成分名)が含まれるので、□□の機能があります」と表示する。
RCT、SRに関わらず関与成分の名称も表示する。 - 「届出表示」は「機能性表示」と表示する。
- 定型文の変更:「本品は、特定保健用食品とことなり、機能性及び安全性について国による評価を受けたものではありません。届け出られた科学的根拠の情報は消費者庁のウェブサイトで確認できます。」
- 摂取上の注意:医薬品及び他の機能性関与成分との相互作用、過剰摂取等に係る注意喚起等について、当該機能性関与成分の安全性に関する科学的根拠を踏まえて具体的に表示する。
- 医薬品と異なり、疾病の診断、治療、予防を目的としたものではない旨又は医薬品ではない旨を表示する。
- 疾病に罹患している者は医師に、医薬品を服用している者は医師、薬剤師に摂取について相談すべき旨を表示する。
届出確認期間の見直し
2025年4月1日施行、即日実施で届出られた内容を確認し受け付ける期間が変更されました。
従来は60日でしたが、2025年4月1日以降は60営業日に変更されました。
また、新規成分に係る届出資料を慎重に確認する手続きとして、表示内容等の確認に時間を要すると
消費者庁長官が認める場合、特例として期間が延長され、専門家からの意見聴取が行われます。
その際の受け付け期間は120営業日となります。
その他信頼性の確保のための措置
・PRISMA2020の準拠について、2025年4月からの新規届出から導入
・届出後の定期的な自己評価・公表など、届出後の遵守事項の遵守を要件化
自社原料の2024年状況
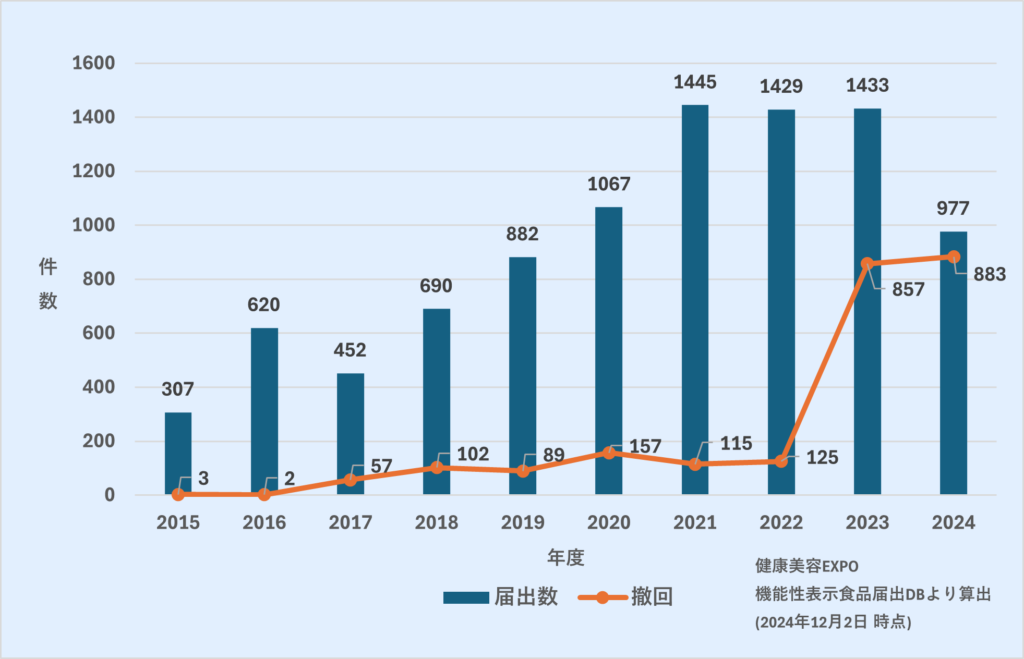
こうした一連の流れにより、2024年の機能性表示食品の届出数は大きく減少。
受理件数も伸び悩みました。
そんな中、2024年に機能性表示食品対応原料として受理された、当社の3原料をご紹介します。
茶花乾燥エキスIC
『取り込まない』『貯めない』『分解』3つの力で脂肪に作用
- サプリメント剤型 17製品
- 粉末飲料剤型 6製品
- 合計 23製品

バナバエキス
注目の血糖値上昇抑制素材
- サプリメント剤型 9製品
- 粉末飲料剤型 1製品
- 合計 10製品
SOD B
脅威の抗酸化能を持つ酵素
- サプリメント剤型 1製品
- 合計 1製品
機能性表示食品の開発をサポートしています
当社では、このように日々変化する消費者庁の動向状況を捉え、届出書類の作成サポートや、届出業務のサポートを承っております。
また、少しずつですが当社原料の受理実績が増えてきており、新しい訴求への対応や、新たな原料の対応への挑戦にも取り組んでいます。
機能性表示食品で他製品と差別化を図りたい、そんなお悩みをお持ちでしたら当社で開発をサポートいたします。
ご興味がございましたらお気軽にお問い合わせください。
お問い合わせはこちらから。












いろいろなモノを口に入れすぎて、最近では植物エキスの苦味も美味しく感じるようになりました。